ალუმინი ბუნებაში ერთ-ერთი გავრცელებული ელემენტია. იგი დედამიწის ქერქის 8,8% -ს შეადგენს. ალუმინი ლღვება 660°C ზე, დუღს 2327რკინის ყუთს°C -ზე. ეს ელემენტი გამოირჩევა დიდი სითბოგამტარობითა და ელექტრომაგნიტურობით. ამ თვისებებით იგი მხოლოდ სპილენძს ჩამოუვარდება. 8,80% დედამიწის ქერქში, ყველა ელემენტის გავრცელების მიხედვით, მესამე ადგილზეა ჟანგბადისა და სილიციუმის შემდეგ და მეტალებს შორის პირველია გავრცელების მხრივ. ყოველი მეოცე ატომი დედამიწის ქერქში ალუმინია.
ალუმინი დაძველების პროცესისას არაჩვეულებრივ სიმტკიცეს იჩენს. მას “სოციალიზმის მეტალი” უწოდეს. ლითონურ ალუმინს უფრო დიდი მნიშვნელობა აქვს ტექნიკის განვითარებისთვის, ვიდრე ალუმინის ყველა ნაერთს ერთად აღებულს.
1825 წლისათვის ალუმინი 1800-ჯერ ძვირად ფასობდა, ვიდრე რკინა, დღეს რკინაზე სამჯერ ძვირია. 1886 წელს იაპონელმა 21 წლის ჩარლზ ჰოლმა ალუმინის ჟანგი გახსნა ნატრიუმის ფტორალუმინატში და მოახდინა ელექტროლიზი. ამის შემდეგ ალუმინი გახდა წარმოების მეტალი და იწარმოება ელექრტოლიზით.

ელექტროლიზით ალუმინის მიღება მაღალ ტემპერატურაზე მიმდინარეობს. საელექტროლიზო აბაზანა რკინის ყუთს წარმოადგენს, რომლის შიგა კედლები ცეცხლგამლე მასალით არის მოპირკეთებული და მის ზემოთ გრაფიტის ან ნახშირის სქელი შემონაფენია, რომელიც კათოდის როლს ასრულებს, ანოდად კი გამოყენებულია ნახშირის ელექტროდი. ელექტროლიზის პროცესი 1000°C -ზე
მიმდინარეობს. გამღვალ კრიოლითში გახსნილი ალუმინის ოქსიდის ნეფელინები ელექტროლიზის დროს გამოყოფილი ალუმინი იკრიფება ყუთის ფსკერზე თხევად მდგომარეობაში, რომელსაც დროდადრო უშვებენ საელექტროლიზო აბაზანიდან. მიღებული ალუმინის გასუფთავება მინარევებისგან მოითხოვს მის გადამუშავებას ხელმეორედ:
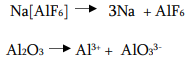
ნალღობში დენის გატარებისას კათოდზე აღდგება Al3+ იონი, ხოლო კათოდზე იჟანგება AlO3
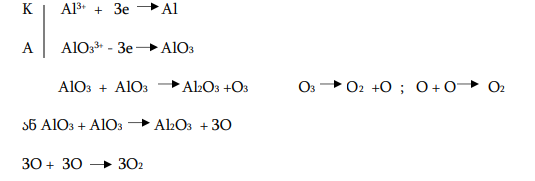

ალუმინის მნიშვნელოვანი ნაერთები:
Al2O3 – ალუმინის ოქსიდი
ალუმინის ოქსიდი ბუნებაში მინერალი კორუნდის არსებობს, რომელიც გამოირჩევა დიდი სიმაგრით. მისი სუფთა კრისტალები გამჭვირვალე და უფეროა, მაგრამ ხშირად ის შეფერილია: თუ ის შეიცავს ცოტაოდენ ქრომს, ღებულობს წითელ ფერს და ამ მინერალს „ლალი“ ეწოდება. თუ ის შეიცავს ტიტანს და რკინას მას ლურჯიფერი აქვს „საფირონი“ ეწოდება. კორუნდი ხელოვნურად მიიღება Al2O3-ის გალღობით, ხოლო მასში ამა თუ იმ მინარევის შეტანით მიიღება ხელოვნური ძვირფასი ქვა -ზურმუხტი. თავისი ქიმიური შედგენილობით ზურმუხტი წარმოადგენს ალუმინისა და ბერილიუმის სილიკატს, რომლის მწვანე შეფერილობა განპირობებულია ქრომის ოქსიდით.
ალუმუნის ოქსიდის მიღება:
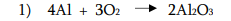
2) ალუმინის ჰიდროქსიდის გახურებით:
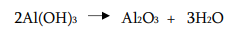
Al2(SO4)3 .18H2O – ალუმინის სულფატი, კრისტალჰიდრატია. გამჭვირვალე უფერო კრისტალებია, რომლის გაუწყლოვებით მიიღება Al2(SO4)3 –თეთრი ფხვნილი. მას იყენებენ წყლის გასაწმენდად. წყალში განიცდის ჰიდროლიზს:
Al2(SO4)3 + 6HOH 2Al(OH)3 + 2H2SO4
ჰიდროლიზის შედეგად წარმოიქმნება ალუმინის ჰიდროქსიდი, რომელსაც აქვს ადსორბციის დიდი უნარი, ამიტომ იგი გამოიყენებ მღვრიე წყლის გასაწმენდად, წყალში გახსნისას მიდის შემდეგი რეაქცია:
Al2(SO4)3 + 6HOH 2Al(OH)3 + 2H2SO4
ჰიდროლიზის შედეგად წარმოიქმნება Al(OH)3 ,რომელსაც აქვს ადსორბციის დიდი უნარი, ამიტომ იგი გამოიყენება მღვრიე წყლის გასაწმენდად. წყალში გახსნისას მიდის შემდეგი რეაქცია:
Al2(SO4)3 + 3Ca(HCO3)2 3CaSO4 +2Al(OH)3 + 6CO2
ჩვეულებრივ შაბის ქვეშ იგულისხმება: K2SO4 . Al2(SO4).24H2O ან 2KAl(SO4)2.12H2O გამოიყენება წყლის დასაწმენდად,ტყავის მრეწველობაში,საკონდიტრო წარმოებაში, მედიცინაში.
მინერალები:
კორუნდი- Al2O3
ლალი (წითელი კორუნდი) –Al2O3 (0,3% Cr2O3)
საფირონი (ლურჯი კორუნდი)- Al2O3 (0,2% Ti2O3) ( Fe+2,Fe+3 )
ფირუზი-CuAl6PO4(OH)6 · 5H2O
ზურმუხტი-3BeO · Al2O3 · 6SiO2 (0,3% Cr2O3)
ალექსანდრიტი- BeO · Al2O3 (Cr2O3 მინარევი)
იისფერი კორუნდი -ამეთვისტო (n SiO2 · Al2O3)
ალუმისგან მისგან ამზადებენ ქიმიურ აპარატებს, სადენებს, კონდენსატორებს და სხვა. 0,005 მმ სისქის ალუმინის კილიტა გამოიყენება კვებისა და ფარმაცევტულ მრეწველობაში- პროდუქტების და პრეპარატების შესაფუთად.
მშენებლობასა და არქიტექტურაში ფართოდ იყენებენ „ვერცხლისებრ“ საღებავსალუმინის ფხვნილისა და მინერალური ზეთის ნარევს. იგი ნაკეთობას არა მარტო ლამაზ შესახედაობას ანიჭებს, არამედ იცავს ქიმიური რღვევისაგან. ყოველდღიურ ცხოვრებაში ალუმინი დამკვიდრდა უმთავრესად სამზარეულო ჭურჭლის სახით. სიმსუბუქისა და სიმტკიცის გარდა , აქ არსებითია ალუნინის სხვა ძვირფასი
თვისებებიც -მაღალი თბოგამტარობა, ცივი და ცხელი წყლის მიმართ მდგრადობა, საჭმელში არსებული სუსტი ორგანული ნჟავების მოქმედებისას წარმოქმნილი ნაერთების არატოქსიკურობა.
მისი ზოგიერთი შენადნობი (მაგ, დურალუნინი) სიმტკიცით ფოლადს არ ჩამოუვარდება, მათი იყენებენ მანქანათა და გენმთმშენებლობაში, საავიაციო ტექნიკაში, მეტროპოლიტენის სადგურებისა, შენობების მოსაპირკეთებლად. ალუმინის შენადნობების ფართოდ გამოყენებას განაპირობებს მათი სიმსუბუქე, სიმტკიცე , ჰაერისა და წყლის მიმართ მედეგობა, კარგი თბო და
ელექტროგამტარობა და კარგი სამსხმელო თვისებები. ალუმინი ცოცხალი ორგანიზმისათვის შეუცვლელი მიკროელემენტია იგი მონაწილეობს ეპითეტური და შემაერთებელი ქსოვილის აგებაში( რომელიც მთელი მასის 50% -ს შეადგენს), ასევეა
ფოსფორის მიმოქცევაში. გამოიყენება მედიცინაში: Al(OH)3-დერმატოლოგიაში, სტომატოლოგიაში. Al(CH3COO)3 – ალუმინის აცეტატი (ბუროვის ხსნარი) ანთების საწინააღმდეგო საშუალება.

“სუფთა ალუმინს როგორც კონსტრუქციულ მასალას თითქმის არ გამოიყენებენ, იხმარება მხოლოდ მისი შენადნობები.
ალუმინო-მაგნიუმიანი Al – Mg. Al – Mg სისტემის შენადნობები ხასიათდებიან დამაკმაყოფილებელი სიმტკიცის, კარგი პლასტიკურობის, ძალიან კარგი შედუღების და კოროზიისადმი მდგრადობის შეხამებით. ამის გარდა, ეს შენადნობები გამოირჩევიან მაღალი ვიბრომდგრადობით
ამ სისტემის შენადნობებში, მაგნიუმის შემადგენლობა განისაზღვრება 6 %-ით, იქმნება შეერთების ევტექტიკური სისტემა Al3Mg2-სა და მყარ ნარევს შორის ალუმინის საფუძველზე. მრეწველობაში ფართოდ გამოიყენება შენადნობები სადაც Mg-ის შემცველობა მერყეობს 1-დან 5 %-მდე.
Mg-ის შემცველობის ზრდასთან ერთად იზრდება შენადნობის სიმტკიცეც. მაგნიუმის ყოველი პროცენტი ზრდის სიმტკიცის ზღვარს 30 მპა-ით, ხოლო დენადობის ზღვარს – 20 მპა-ით. ამასთან ფარდობითი დაგრძელება მცირდება უმნშვნელოდ და 30-35 %-ის ფარგლებშია”
ბოლო დროს გამოჩნდა ალუმინის შენალღობები გერმანიუმთან და ვერცხლთან, მაგრამ სამწუხაროდ გერმანიუმი იშვიათი ელემენტია, ვერცხლი კი ძვირფასი მეტალი, ამიტომ ამ შენალღობებს ფართო გამოყენება არ აქვს.

1827 წელს ალუმინი მიიღო ალუმინის ქლორიდისა (
წყარო:
ქიმია და ადამიანი
მოკლე ქიმიური ენციკლოპედია
მინერალური ნედლეულის ქიმია
ლითონმცოდნეობა და ფოლადის თერმული დამუშავება.
