ქიმიურ ელემენტთა პერიოდული სისტემა დიმიტრი მენდელეევმა 1869 წლის 1 მარტს აღმოაჩინა. ამ დროისთვის ცნობილი იყო მხოლოდ 63 ქიმიური ელემენტი(დღეს 118 ელემენტია ვიცით). რა თქმა უნდა ეს არ იყო პირველი მცდელობა, რომ ამ 63 ელემენტის კლასიფიკაცია მომხდარიყო, მეცნიერები ცდილობდნენ რაღაცა ნიშნით ელემენტების დაჯგუფებას, ეძებდნენ კანონზომიერებებს მათ თვისებებს შორის. ქიმიური ელემენტების სისტემატიზაციის ცდები (მსგავსი ქიმიური თვისებების მიხედვით) ჯერ კიდევ XIX საუკუნის 30-იან წლებიდან დაიწყო.
1864 წელს მაიერმა ატომურ მასათა მონაცემების საფუძველზე შეადგინა ტაბულა, რომელშიც აჩვენა ელემენტთა რამდენიმე ჯგუფის ატომური მასებისა და თვისებების ურთიერთშესაბამისობა, მაგრამ ზოგადი თეორიული დასკვნა მას არ გაუკეთებია.
დიმიტრი მენდელეევი თავისი ფუნდამენტური ნაშრომის “ქიმიის საფუძველები” მერვე გამოცემაში პერიოდული სისტემის განმამტკიცებელ მეცნიერთა რიცხვში იხსენიებს პეტრე მელიქიშვილს, რომლის გამოვკვლევებზე დაყრდნობით მენდელეევმა ქიმიურ ელემენტს პრაზედიუმს პერიოდულ სისტემაში სათანადო ადგილი მიაკუთვნა, 1882 წელს აღმოჩენილი ეს ელემენტი შესწავლილი არ იყო. ზუსტად არ იყო განსაზღვრული მისი ატომური მასა. გაურკვეველი რჩებოდა მისი ადგილი პერიოდულ სისტემაში. მეცნიერთა ერთი ნაწილი მიიჩნევდა, რომ პრაზეოდიუმის ადგილი პერიოდული სისტემის V ჯგუფშია ნიობიუმსა და ტანტალს შორის. მენდელეევი კი მიიჩნევდა, რომ პრაზეოდიუმი III ჯგუფის ელემენტია.
პეტრე მელიქიშვილმა გადაწყვიტა ამ საკითხის შესწავლა. მელიქიშვილმა მიიღო პრაზეოდიუმის პეროქსიდი და დაადგინა, რომ ის მჟავა კი არა ფუძე თვისებისაა და არაფერი აქვს საერთო ნიობიუმისა და ტანტალის ანალოგიურ ნაერთებთან. უსაფუძვლოა პრაზეოდიუმის მე-5 ჯგუფისათვის მიკუთვნების მცდელობა-მისი ადგილი მე-3 ჯგუფშია.
ასევე მენდელეევის შეფასებით, ელემენტთა პერიოდული სისტემის განმტკიცებას ხელი შეუწყო პეტრე მელიქიშვილისა და მისი მოწაფის პისარჟევსკის შრომებმა.
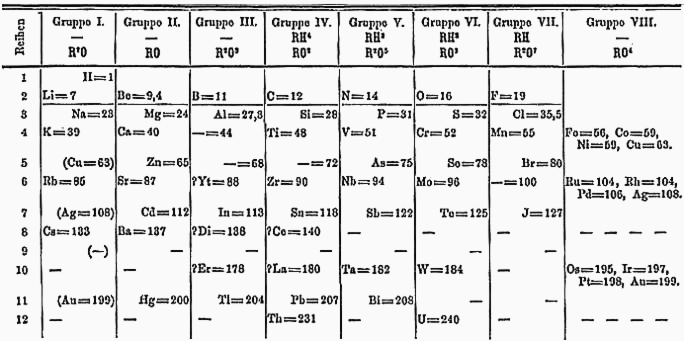
მენდელეევის 1871 წლის პერიოდული სისტემა

დიმიტრი მენდელეევი
მედელეევმა 63 ქიმიური ელემენტის კლასიფიკაციის საფუძვლად მიიჩნია ელემენტის ფარდობითი ატომური მასა და დაალაგა ეს ელემენტები ფარდობითი ატომური ზრდის მიხედვით, შემდეგ დააკვირდა ამ ელემენტების თვისებების ცვლილებას და მიაგნო კანონზომიერებას, რომელიც მდგომარეობდა შემდეგში: ელემენტების თვისებები განუსაზღვრელად არ იცვლებოდა, არამედ გარკვეული პერიოდის შემდეგ თვისებები მეორდებოდა, ემორჩილებოდა განსაზღვრულ პერიოდულობას. მაგალითად, ლითიუმი ტუტე მეტალია, შემდეგ მოდის ბერილიუმი, შემდეგ აფოტერული(ახასიათებს როგორც მეტალური, ისე არამეტალური თვისებები) თვისებების მქონე ელემენტი ბორი, შემდეგ არამეტალური ბუნების ელემენტები და მთავრდება ინერტული აირით-ნეონით(მე-10 ელემენტი), ხოლო მე-11 ელემენტი ისევ ტუტე მეტალია, შემდეგ მას მოყვება მეტალი მაგნიუმი, შემდეგ ისევ ამფოტერული მეტალი ალუმინი, შემდეგ ისევ არამეტალები და ბოლოს ინერტული აირი-არგონი. მენდელეევმა, როდესაც ქიმიური ელემენტები დაალაგა ერთ მწკრივში, გარკვეული ინტერვალის შემდეგ ისევ მეორდებოდა ტუტე მეტალი, მეტალი, ამფოტერული მეტალი, არამეტალი და მთავრდებოდა ინერტული აირით. მედელეევი ვარაუდობდა, რომ პერიოდულად მეორდებოდა ამ ელემენტის ქიმიური თვისებები, თუმცა წააწყდა წინააღდეგობას. ელემენტი ბერილიუმი, რომელიც მე-4 ელემენტია პერიოდულ სისტემაში, ფარდობითი ატომური მასა იყო 13.5 იმ დროისთვის არასწორად იყო განსაზღვრული, (სინამდვილეში იყო 9), თუმცა მენდეელვმა მაინც მიაკუთვნა მე-4 ადგილი პერიოდულ სისტემაში. დღეს უკვე გასწორდა ბერილიუმის ფარდობითი ატომური მასა და დადასტურდა მენდელეევის მსჯელობისა და ჰიპოთეზის სისწორე. გამონაკლისი დაუშვა ასევე არგონისა და კალიუმის შემთხვევაში. არგონი ინერტული აირია, რომელიც მე-18 ადგილზეა და მისი ფარდობითი ატომური მასა არის 39.95, მომდევნო ელემენტის უნდა ყოფილიყო უფრო მეტი, მაგრამ კალიუმიუს ფარდობითი ატუმური მასა არის 39.10

მენდელეევის ხელნაწერი. 1869 წელი, ქიმიურ ელემენტთა პერიოდული სისტემა.
მასების ზრდის მიხედვით რომ მომხდარიყო დალაგება, მენდელეევი მიიღებდა არეულობას, ყველაზე უფრო ძლიერი ტუტე მეტალი, კალიუმი, მოხვდებოდა ინერტული აირების ქვეჯგუფში, არგონი კი მოხვდებოდა ტუტე მეტალების ქვეჯგუფში, რის შედეგადაც სრულიად დაირღვეოდა თვისებების პერიოდულობა.
პერიოდულობის კანონი ორი ფორმულირება არსებობს: ერთი, რომელიც მენდელეევმა ჩამოაყალიბა, რომლის მიხედვითაც ქიმიური ელემენტების თვისებები, ასევე ამ ელემენტებიდან წარმოქმნილი ნივთიერებების (როგორც მარტივი, ისე რთული) ფორმები და თვისებები, პერიოდულ დამოკიდებულებაშია ატომური მასის სიდიდესთან.
თანამედროვე ფორმულირება პერიოდულობის კანონის დაკავშირებულია ატომბირთვის მუხტის სიდიდესთან. ქიმიური ელემენტების თვისებები, ასევე ამ ელემენტების მიერ წარმოქმნილი ნაერთების ფორმები პერიოდულ დამოკიდებულებაშია ატმგულის მუხტის სიდიდესთან. როდესაც აღმოაჩინეს, რომ ატომში შედის ატომბირთვი და მის გარშემო მოძრავი ელექტრონები. ატომბირთვი თავისმხრივ შეიცავს პროტონებს და ნეიტრონებს. აქედან გამომდინარე, ელემენტის განმსაზღვრელს წარმოადგენს არა ფარდობითი ატომური მასა, არამედ ატომბირთვში პროტონების რაოდენობა(ატომბირთვის მუხტის სიდიდე). ატომბირთვის მუხტის სიდიდე პერიოდულ სისტემაში ქიმიური ელემენტის რიგით ნომერს ემთხვევა. მაგალითად, ლითიუმი, მე-3 ელემენტი პერიოდულ სისტემაში, ასევე პროტონების რაოდენობაც 3.
პერიოდული სისტემა და მისი სტრუქტურა
ყოველი პერიოდი იწყება s-ელემენტებით, რომელსაც გარე შრეშე ერთი s-ელექტრონი აქვს. როგორც წესი, ეს ტუტე მეტალია. პერიოდი მთავრდება p-ელემენტით, რომელსაც გარე შრეზე ორი s-და ექვსი p-ელექტრონი აქვს, როგორც წესი ეს კეთილშობილი აირია. A ჯგუფებში მოთავსებულია s და p ელემენტები. B ჯგუფებში d ელემენტები, შესაბამისად ლანთანი La და აქტინიუმი Ac არამედ თხუთმეტ-თხუთმეტ, კერძოდ ლანთანიდან ლუტეციუმის ჩათვლით-ლანთაიდების ჯგუფი და აქტიმიუმიდან ლოურენსიუმის ჩათვლით-აქტინიდების ჯგუფი. პერიოდული სისტემა, რომ არ გადატვირთულიყო , აღნიშნული ელემენტები გამოტანილია პერიოდული სისტემის ქვემოთ-ეს f ელემენტებია.
ელემენტთა თვისებები პერიოდში
ატომბირთვის მუხტი იზრდება
გარე შრეზე ელექტრონთა რიცხვი იზრდება
ბირთვთან ელექტრონის მიზიდვა ძლიერდება
ატომის რადიუსი მცირდება
მეტალური თვისებები მცირდება, არამეტალური ძლიერდება
შესაბამისი ოქსიდის და ჰიდროქსიდის ფუძე თვისებები მცირდება და მჟავა თვისებები ძლიერდება.
ელემენტების პერიოდულობის ცხრილი
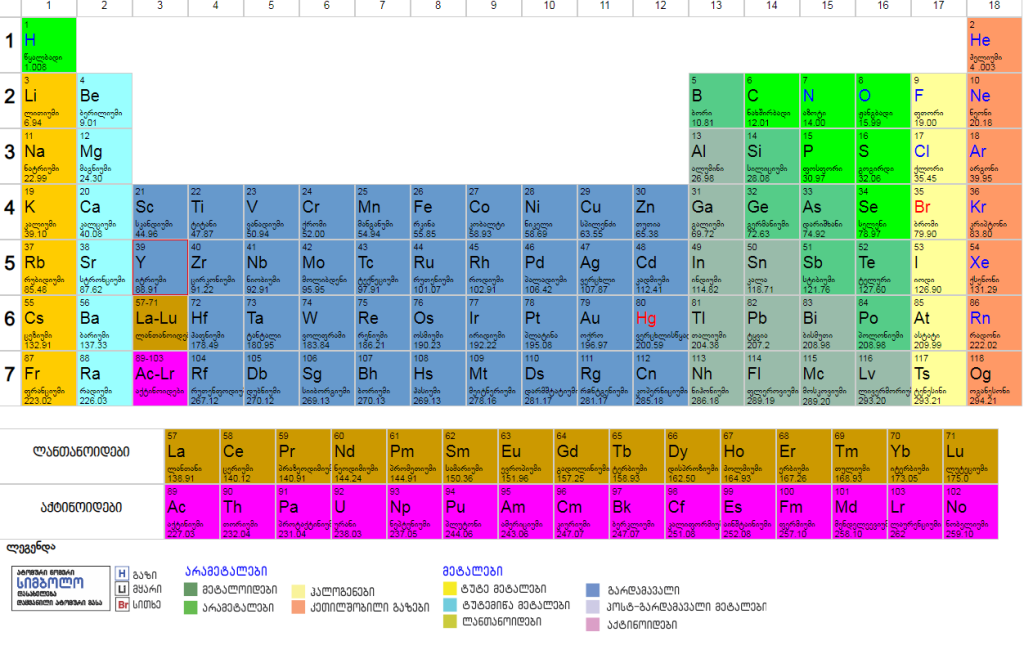
წყარო:
http://chemistry.ge/periodic_table/
უმთავრესი ქიმიური ელემენტები და მათი შესაბამისი ქვეჯგუფები-ო.მანჯგალაძე
ქიმიური ელემენტები და ალოტროპია-კ.სესიაშვილი
https://www.chemistryworld.com/features/the-father-of-the-periodic-table/3009828.article
